Hepatotoxicidad por paracetamol
El paracetamol (acetaminofén o acetaminofeno) fue introducido hace medio siglo, considerándose un analgésico eficaz y seguro. Sin embargo, desde la primera descripción de hepatotoxicidad en 1966 (1), se ha acumulado un conocimiento considerable acerca de su patogenia y tratamiento. En la actualidad la toxicidad es una causa considerable de mortalidad por intoxicación en muchos países. Su pronóstico depende en forma importante de su reconocimiento oportuno y del inicio de las medidas terapéuticas específicas en forma temprana.
Farmacocinética
La dosis terapéutica de paracetamol es de 10 a 15 mg/kg en niños y 250 a 1000 mg en adultos, siendo la dosis máxima recomendada 80 mg/kg en niños y 4 g en adultos por día. La dosis tóxica mínima es de 150 mg/kg para niños y 10 g para adultos, sin embargo esta dosis puede variar dependiendo de los niveles basales de glutatión entre otros factores. El paracetamol se absorbe rápidamente, alcanzando concentraciones máximas en plasma a las 2 horas de ingerido. La concentración plasmática terapéutica es de 10 a 20 µg/mL. La vida media del paracetamol es de 2 a 4 horas.
Patogenia de la toxicidad
En condiciones normales el paracetamol es glucuronizado y sulfatado en el hígado en un 90% y luego eliminado por vía urinaria. Del 10% restante, la mitad es excretada directamente por los riñones y la otra mitad es metabolizada por el citocromo P450. La subfamilias CYP2E1, 1A1 y 3A4 de este citocromo transforman al paracetamol en N-acetil-p-benzoquinonemina (NAPQI), un metabolito intermedio altamente reactivo y electrofílico. Este compuesto es capaz de unirse covalentemente a macromoléculas del hepatocito, produciendo stress oxidativo y necrosis hepatocelular. NAPQI es conjugado rápidamente con glutatión, formando cisteína y mercaptano, que no son tóxicos. Cuando hay una sobredosis de paracetamol, las otras vías se saturan y una proporción mayor del medicamento va a la vía del citocromo. Cuando las reservas de glutatión se depletan en un 70%, NAPQI comienza a acumularse produciendo daño hepatocelular (2). De lo anterior se desprenden los factores que pueden influir en la toxicidad por paracetamol:
- Inducción del citocromo P450: Puede ser por otros medicamentos o por consumo crónico de alcohol. Es interesante notar que la ingesta aguda de alcohol puede ser incluso protectora frente al daño por paracetamol, ya que compite en su metabolismo por CYP2E1, disminuyendo la producción de NAPQI (3).
- Depleción de glutatión: Períodos de ayuno y desnutrición, condiciones frecuentes en el alcoholismo, pueden llevar a depleción de glutatión y aumento del riesgo de toxicidad por paracetamol (4).
- Factores genéticos: Los polimorfismos existentes en los diferentes citocromos pueden explicar diferencias en la susceptibilidad a la intoxicación. Asimismo, se ha reportado que la glucuronización disminuida en el síndrome de Gilbert aumenta la toxicidad por paracetamol.
Manifestaciones clínicas
Si bien las manifestaciones tempranas de toxicidad por paracetamol son leves e inespecíficas (y no predicen la gravedad de la hepatotoxicidad), son importantes de reconocer tempranamente.
- Etapa I (primeras 24 h): Puede haber náuseas, vómitos, letargia, aunque puede ser completamente asintomático.
- Etapa II (24 a 72 h): Comienzan las evidencias de hepatotoxicidad en los exámenes de laboratorio, al mismo tiempo que los síntomas iniciales pueden cambiar por dolor en hipocondro derecho, con hepatomegalia. Puede aparecer concomitantemente oliguria y pancreatitis.
- Etapa III (72 a 96 h): Se llega al máximo de elevación de transaminasas, llegando en ocasiones a exceder de 10.000 IU/mL. Clínicamente puede haber ictericia, encefalopatía y coagulopatía. El 25 a 50% de los afectados presenta concomitantemente insuficiencia renal por necrosis tubular aguda.
- Etapa IV (4 días a 2 semanas): Los pacientes que sobreviven la etapa anterior entran a una etapa de recuperación cuya duración depende de la gravedad del compromiso inicial. Los cambios histológicos afectan preferentemente a la zona III (centrolobulillar), que es la de mayor concentración de CYP2E1. No hay casos reportados de daño hepático crónico por paracetamol.
Diagnóstico
En el manejo inicial es crucial intentar determinar la dosis ingerida y el tiempo de evolución. Cuando la ingestión es con fines suicidas, debe buscarse la presencia de otras sustancias tóxicas concomitantes.
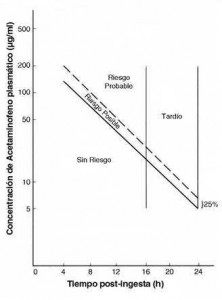
Después de una sobredosis, se debe medir niveles sanguíneos entre las 4 y 24 horas de la ingestión. Niveles tomados antes de las 4 horas no son confiables para la toma de decisiones. El valor obtenido debe evaluarse de acuerdo al nomograma de Rumack-Matthew (ver figura) (5). El diagnóstico de toxicidad por uso crónico de paracetamol es bastante más difícil, ya que los síntomas son de presentación más insidiosa y el dato de ingesta del fármaco no siempre es obtenido en la evaluación inicial. Se debe sospechar hepatotoxicidad por paracetamol cuando un paciente con factores de riesgo (alcoholismo, ayuno, uso de inductores de citocromo P450) ha tomado más de 4 g en un período de 24 h. El diagnóstico diferencial debe incluir la hepatitis isquémica, hepatitis viral, toxicidad por otras drogas o toxinas y el síndrome de Reye.
Tratamiento
El tratamiento de la intoxicación por paracetamol se basa en dos conceptos: Decontaminación gastrointestinal con carbón activado y el uso de N-acetilcisteína (NAC).
- Decontaminación: El uso de carbón activado está indicado en todos los pacientes que se presentan en las primeras 4 horas de la ingestión y después si hay uso de preparados de liberación prolongada o ingesta simultánea de drogas que retarden el vaciamiento gástrico. El carbón activado adsorbe el paracetamol, disminuyendo su absorción en un 90%. Se debe administrar en una dosis única de 1 g/Kg. El carbón activado puede unirse a NAC cuando se administra conjuntamente, pero su absorción es mayor que la requerida para revertir la toxicidad por paracetamol, por lo que no se recomienda aumentar la dosis de NAC.
- N-acetilcisteína (NAC): Es un precursor de glutatión que previene la toxicidad por paracetamol al limitar la acumulación de NAPQI. Además puede unirse directamente a NAPQI como sustituto del glutatión y aumenta la vía no tóxica de sulfatación del paracetamol. En etapas más tardías de la intoxicación, NAC es beneficioso a través de mecanismos anti-inflamatorios y antioxidantes, además de tener propiedades inotrópicas y vasodilatadores.
La máxima eficacia de la NAC se produce cuando se usa dentro de las primeras 10 horas de la ingesta, reduciendo la hepatotoxicidad de 50 a 5% y la mortalidad global de un 8 a 0%. Sin embargo, el uso más tardío también ha probado ser beneficioso en estos pacientes. Las indicaciones de tratamiento con NAC son:
- Pacientes con concentraciones plasmáticas sobre la línea de toxicidad posible en el nomograma de Rumack-Matthew (figura).
- Ingesta única mayor a 7,5 g en un adulto (o 150 mg/kg en niños) si no hay disponibilidad de contar con niveles dentro de las primeras 8 horas.
- Pacientes con hora de ingestión desconocida y niveles plasmáticos sobre 10 µg/mL.
- Pacientes con historia de consumo excesivo de paracetamol y evidencias de hepatotoxicidad en exámenes de laboratorio.
La dosis recomendada es una carga inicial de 140 mg/kg seguida de 17 dosis de 70 mg/kg cada 4 horas por vía oral (6). La formulación intravenosa, usada en Europa, no está disponible en Chile. En nuestro país la única presentación disponible es el “Mucolítico” en frascos de 15 mL con una concentración de 1 g por cada 10 mL (un adulto de 70 kg requeriría una dosis de carga de aproximadamente 6 frascos). La NAC tiene un olor desagradable y puede producir náuseas o vómitos que disminuyen al mezclarse con jugo de frutas o bebidas, agregando hielo y/o administrando anti-eméticos.
Otras medidas: El uso de cimetidina con el fin de inhibir el citocromo P450 no ha tenido el efecto esperado. La hemodiálisis y la hemoperfusión son alternativas de manejo que tampoco han demostrado claro beneficio. El uso de sistemas de diálisis hepática (p. ej. MARS) podría ser de utilidad en casos que se presentan con más de 10 horas de evolución (7).
Indicación de trasplante hepático
Cuando hay falla hepática fulminante establecida, la NAC debe administrarse continuadamente hasta obtener mejoría del tiempo de protrombina (INR < 2). El criterio de indicación de trasplante hepático en pacientes con falla hepática fulminante por paracetamol clásicamente propuesta por el King’s College Hospital incluyen factores diferentes a los usados para otras etiologías(8).
Criterios de indicación de trasplante hepático en falla hepática fulminante por paracetamol (criterios del King Collage Hospital). El valor predictivo positivo para mortalidad sin trasplante de estos criterios es de 88%:
– pH arterial < 7,3 (independiente del grado de encefalopatía)
o
– Encefalopatía grado III o IV y
– Protrombina > 100 segundos y
– Creatinina > 3,4 mg/dL
Más recientemente se ha propuesto como criterio de trasplante un tiempo de protrombina en segundos que exceda el tiempo de sobredosis en horas o cualquiera de los siguientes criterios: INR>5 en cualquier momento, acidosis metabólica, hipoglicemia o insuficiencia renal (9).

